|
||||
|
ЧАСТЬ IX ВИЧ—ИНФЕКЦИЯ, СИФИЛИС, ТУБЕРКУЛЕЗ У ДЕТЕЙ ГЛАВА 1. ВИЧ—ИНФЕКЦИЯ ПРИЧИНЫ И МЕХАНИЗМЫ РАЗВИТИЯ ВИЧ—инфекция у детей – явление распространенное и актуальное для всех стран мира. Заражение детей чаще всего происходит через плаценту, при этом вирус СПИДа в отличие от других ретровирусов не передается потомству в виде вставки в геном, а проникает в плод непосредственно с кровью матери в процессе беременности и родов. Ученые доказали, что риск заражения детей через грудное молоко очень велик. Передача вирусов может произойти при переливании крови или ее компонентов, а также в случае использования инструментария, загрязненного кровью больных или вирусоносителей. Как правило, источником ВИЧ для детей являются женщины из группы риска (употребляющие наркотики внутривенно, имеющие беспорядочные половые связи). Более чем 3/4 случаев заражения детей ВИЧ связаны с перинатальным инфицированием, и лишь в 20–25 % случаев вирус поступает через кровь и ее препараты, а также инфицированные иглы. В России благодаря активно проводимой работе по борьбе с гемоконтактными инфекциями случаи внутрибольничного заболевания детей ВИЧ не регистрируются с 1991 г. Первый случай СПИДа у ребенка был зарегистрирован уже через 18 месяцев после описания заболевания: в США в 1983 г. было зафиксировано заражение ВИЧ ребенка при гемотрансфузии. По данным ВОЗ, наибольшее число ВИЧ—инфицированных детей в мире (около 93 %, что в 2006 г. составило 12 млн человек) зафиксировано в Африке. Только по данным учтенных случаев заражения, к концу 1996 г. в мире с начала пандемии было зарегистрировано 2,6 млн инфицированных детей, из них 1,7 млн находились в стадии СПИД, умерли от инфекции 1,4 млн детей. В эпидемиологически неблагополучных регионах мира по ВИЧ—инфекции первые места в списках причин смерти занимает СПИД, в особенности это относится к странам Африки. Однако и в высокоразвитых странах численность ВИЧ—инфицированных детей продолжает расти: по данным Американского центра по профилактике и контролю за заболеваниями, к концу прошлого столетия в США были инфицированы более 7000 детей в возрасте до 5 лет. В США и странах Западной Европы среди причин заражения на первом месте стоит трансплацентарное инфицирование детей ВИЧ, и лишь в 11–17 % случаев заражение происходит при переливании крови и ее компонентов. В России, Румынии до недавнего времени преобладало нозокомиальное (внутрибольничное) заражение детей, сейчас также лидирует трансплацентарное инфицирование. В развивающихся странах лидирует перинатальное инфицирование. Во всех странах идет увеличение числа больных ВИЧ—инфекцией детей, и тенденция эта, по всей видимости, будет сохраняться в мире и в дальнейшем, так как даже поставленные в известность о грозящей ребенку опасности ВИЧ—инфицированные женщины не всегда соглашаются на прерывание беременности. Следует заметить, что в России по сравнению с другими странами довольно высок удельный вес женщин в группе ВИЧ—инфицированных, что говорит о серьезности проблемы ВИЧ / СПИД у детей нашей страны. По данным многочисленных исследований, частота инфицирования ВИЧ новорожденных при родах довольно высока. Так, в США 27 % перворожденных детей заражаются ВИЧ от больной матери, в Европе аналогичный показатель составил 13 %, в Найроби частота заражения перворожденных – 45 %. Последующие беременность и роды увеличивают риск заражения ребенка в 1,5 и более раз. Однако такие показатели удалось существенно снизить (до 5–6 %) за счет проведения лекарственной профилактики азидотимидином. Сама по себе беременность благоприятствует развитию СПИДа вследствие того, что она обычно сопровождается подавлением иммунитета матери с целью уменьшения риска развития выработки ее организмом антител против плода. При этом инфицирование вирусом СПИДа еще более ухудшает иммунологическую картину, так как вирус избирательно поражает Т—лимфоциты—хелперы (вплоть до полной их гибели). Количество Т—лимфоцитов—хелперов резко снижается, возникают необратимые нарушения в системе клеточной регуляции иммунного ответа. Следует заметить, что при физиологическом течении беременности отношение числа клеток Т—лимфоцитов—хелперов к Т—супрессорам снижается. Нормальные иммунологические показатели приходят к норме примерно через 3 месяца после родов. Беременность и последующие роды способствуют резкому прогрессированию заболевания, так как при этом состоянии резко страдают иммунологические показатели крови. Заражение плода происходит при нахождении его в организме матери через плаценту и во время родов, так как при прохождении плода по родовым путям происходит травмирование последних. У 14 % детей, инфицированных перинатально, при отсутствии профилактических мероприятий к концу первого года жизни развивается СПИД. У 12 % пациентов СПИД диагностируется в течение каждого последующего года, а к 4–му году жизни у 50 % инфицированных детей развивается конечная фаза СПИДа. Показатели смертности в этой группе высоки и составляют 25 % у ВИЧ—позитивных детей в возрасте до 5 лет и 12–14 % ВИЧ—негативных (в контрольной группе показатель смертности не превышал 5 %). Особую группу риска по ВИЧ—инфицированию представляют подростки в силу некоторых социальных и психологических факторов. 1. Беспорядочные половые связи – по данным исследования А. А. Давыдова, в Санкт—Петербурге половым опытом обладает четверть учащихся школ и училищ в возрасте 15 лет, к 16 годам – 35 %, к 17 годам – 50 %, причем треть подростков имеет более 3 половых партнеров. 2. Нигилистическое отношение к проблеме СПИДа. Для большинства подростков эта тема является абстрактной, отвлеченной, они полагают, что болезнь непременно их минует, либо относятся к инфекции с пренебрежением и безразличием. Следствием недооценки опасности является низкий показатель использования презервативов – 5 %. 3. Необходимость испытания новых ощущений и высокая степень подверженности чужому влиянию часто способствуют вовлечению подростков в сомнительные сообщества и распространению среди них наркомании. Переоценка собственных возможностей по преодолению зависимости как от наркотиков, так и от группы людей усугубляет положение. Доказана передача ВИЧ и от ребенка, инфицированного, например, в стационаре, к матери в процессе кормления грудью: вирус при этом может проникать в кровь женщины через трещины в сосках. Поэтому для предотвращения инфицирования в развитых странах рекомендуется отказаться от грудного вскармливания и перейти на искусственное вскармливание – питание из бутылочки адаптированными смесями – заменителями грудного молока. Хуже обстоит дело в развивающихся странах, смертность от дистрофии так высока, что заметно превышает риск инфицирования при кормлении грудью, поэтому женщинам не рекомендуется прекращать грудное вскармливание. Замечено, что у детей младшего возраста, инфицированных, как правило, перинатально, заболевание протекает стремительнее и в более тяжелых формах, нежели у детей, зараженных гемотрансфузионным путем (как правило, это дети более старшего возраста). Также у детей до 5 лет возможно развитие ретровирусного синдрома, не описанного у более старших детей при вертикальном заражении. КЛАССИФИКАЦИЯ Американский центр по контролю за заболеваемостью предложил для применения следующую классификацию ВИЧ—инфекции для детей в возрасте до 13 лет, ее авторы выделяют 4 категории клинических проявлений болезни. 1. Клиническая категория N – нет симптомов или может иметься один признак из категории А. 2. Клиническая категория А – маловыраженные симптомы. Эта категория ни В и ни С, характерно наличие двух или более нижеперечисленных признаков: 1) лимфаденопатия (лимфоузлы > 0,5 см в двух и более областях); 2) гепатомегалия; 3) спленомегалия; 4) дерматит; 5) паротит; 6) рецидивирующие респираторные инфекции или синуситы; 7) рецидивирующие средние отиты. 3. Клиническая категория В – умеренно выраженные симптомы. Эта категория ни А и ни С и включает такие признаки, как: 1) анемия, нейтропения и (или) тромбоцитопения, персистирующие более 30 дней; 2) бактериальный менингит, пневмония, сепсис (один эпизод); 3) герпесвирусные бронхиты, пневмонии, эзофагиты; 4) нокардиоз; 5) кандидоз орофарингеальный, трахеальный, персистирующий более 2 месяцев у детей старше 6 месяцев; 6) кардиомиопатия; 7) диарея рецидивирующая или хроническая; 8) гепатит; 9) нефропатия; 10) лейкомиосаркома; 11) герпетический стоматит рецидивирующий (более 2 эпизодов в году); 12) герпес опоясывающий (2 и более эпизодов в году); 13) ЦМВ—инфекция у ребенка старше 1 месяца; 14) ветряная оспа диссеминированная; 15) лимфоидная интерстициальная пневмония или гиперплазия прикорневых лимфоузлов; 16) токсоплазмоз у ребенка старше 1 месяцев; 17) персистирующая лихорадка более 1 месяца. 4. Клиническая категория С – СПИД—индикаторные болезни, исключая ЛИП, тяжелая симптоматика: 1) тяжелые бактериальные инфекции, множественные или рецидивирующие не менее 2 раз за 2 года, которые подтверждаются исследованием гемокультуры, в виде септицемии, пневмонии, менингита, остеомиелита, абсцессов различных органов и полостей, исключая отит, поверхностные кожно—слизистые абсцессы, инфицирование катетера; 2) воспаление пищевода грибковой этиологии, а также грибковая инфекция в легких: бронхиты, трахеиты; 3) внелегочный криптококкоз; 4) криптоспоридиоз или изоспоридиоз с диареей более 1 месяца; 5) диссеминированный гистоплазмоз; 6) лимфома Беркета; 7) пневмоцистная пневмония; 8) кокцидиоидомикоз диссеминированный; 9) ЦМВ—инфекция у ребенка старше 1 месяца, исключая изолированные поражения печени, легких или лимфоузлов; 10) энцефалопатии: наличие прогрессирующих симптомов более 2 месяцев при отсутствии других заболеваний, кроме ВИЧ—инфекции; такие нарушения могут развиваться двумя путями: как задержка развития мозга, нарушение интеллекта, которое подтверждено нейрофизиологическими тестами, или приобретенная микроцефалия, атрофия мозга, что также подтверждается при использовании компьютерной томографии или ядерно—магнитно—резонансным исследованием у ребенка старше 2 лет; приобретенные моторные нарушения (2 или более): парез, патологические рефлексы, атаксия или нарушения походки; 11) саркома Капоши; 12) первичная лимфома головного мозга; 13) В—клеточная лимфома; 14) диссеминированный или атипичный микобактериоз с поражением нескольких органов; 15) микобактериоз avium – комплекс или микобактериоз kansasii диссеминированный; 16) прогрессирующая лейкоэнцефалопатия; 17) токсоплазмоз головного мозга у ребенка старше 1 месяца; 18) вэстинг—синдром (при отсутствии заболеваний, сходных с ВИЧ—инфекцией, объясняющих следующие симптомы: стойкая потеря веса более 10 % от исходного уровня, хроническая диарея (не менее двукратного жидкого стула в течение 30 дней), документированная лихорадка более 30 дней (постоянная или интермиттирующая)); 19) вирус простого герпеса, персистирующий более 1 месяца и вызывающий кожно—слизистые язвы или бронхит, пневмонию, эзофагит у ребенка старше 1 месяца; 20) рецидивирующая сальмонеллезная септицемия. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ Для удобства определения степени тяжести состояния у детей разных возрастов весь их контингент был поделен на три возрастные группы, для каждой группы выраженность поражения иммунной системы определяется количеством клеток лимфоцитов—хелперов в крови. 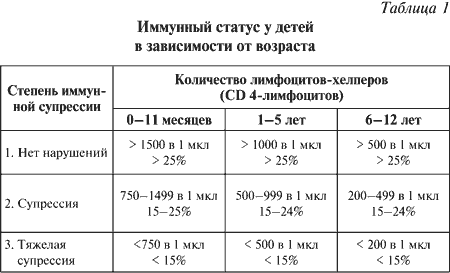 Клиническое течение ВИЧ—инфекции зависит от путей инфицирования: более раннее инфицирование в период внутриутробного развития приводит даже к гибели плода. Кроме того, такие дети рождаются ослабленными, с явными признаками недоразвитости. Заражение во время родов приводит к более позднему появлению признаков инфицирования. Также были выявлены определенные различия в частоте встречаемости тех или иных осложнений ВИЧ у взрослых пациентов и детей: было замечено, что патогенетически ВИЧ—инфекция в детском возрасте имеет некоторые отличительные черты. Прежде всего это относится к возможности развития патологических проявлений еще в эмбриональном периоде за счет иммунных сдвигов. Так, к примеру, дети у матерей с клинически манифестной формой инфекции болеют чаще и тяжелее в отличие от детей, родившихся у матерей с латентной формой инфекции. Следует полагать, что причина этого кроется в выраженном воздействии вируса на плазму, в свойствах самого вируса, его репликационной способности и способности к синцитие—образованию. Именно эти характеристики ВИЧ определяют степень выраженности клиники. У женщин с высоким титром вируса в плазме его большее количество проникает в организм ребенка через плаценту или в период родового акта, и у последнего в большей степени выражен патологический процесс. 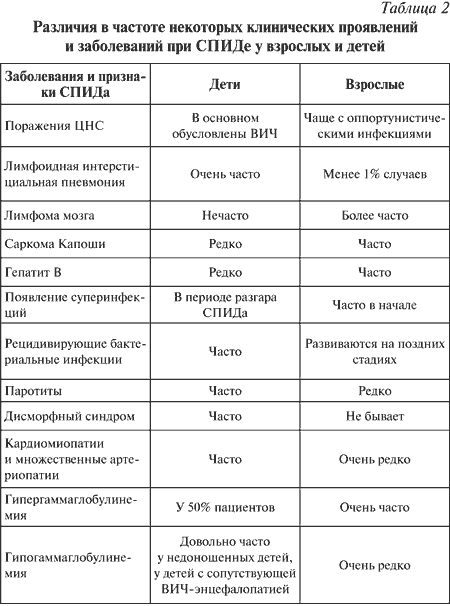 Выявлено, что, если ребенок заразился ВИЧ во внутриутробном периоде, симптоматика развивается уже в течение первых месяцев жизни, в то время как у инфицированных при переливаниях крови и инъекциях на протяжении нескольких лет обычно длится инкубационный период (в среднем для детей с перинатальной ВИЧ—инфекцией он составляет около 1 года, а для детей, которые были инфицированы при проведении гемотрансфузий, – до 3,5 лет). В среднем более трети детей, инфицированных в стационарах, умирают в течение 1–2 лет после заражения, чуть более половины исследованных прожили после заражения 3–4 года, у 10–12 % пациентов выживаемость составила 5 лет. Внутрибольничное заражение детей происходит обычно в реанимационных отделениях и отделениях грудной хирургии. Наиболее частым вмешательством, приводящим к инфицированию ВИЧ, является катетеризация подключичной вены (являлась причиной заражения почти в 50 % случаев), за ней следуют такие манипуляции, как интубация трахеи (17 % случаев), плевральные пункции (9 %). Кроме того, было замечено, что чем меньше возраст ребенка, тем раньше у него развивается сероконверсия. Как показали исследования, у 35 % детей до 7 лет спустя полгода после заражения в крови активно циркулировали антитела к ВИЧ, в то время как у пациентов старше 7 лет эта реакция организма развивалась значительно позже. Чем старше ребенок, тем более клиническая картина болезни у него сходна с таковой у взрослых больных, хотя и имеет свои особенности и укороченный по сравнению со взрослыми латентный период – 3–5 лет. В среднем от момента проявления характерной симптоматики СПИДа пациент может прожить еще около 2,5 лет. Если клинические проявления развиваются на первом году жизни, то ребенок его, как правило, не переживает. Клиника ВИЧ—инфекции при внутриутробном инфицировании развивается спустя полгода после рождения и выражается следующими характерными симптомами: задержка роста наблюдается у 3/4 обследованных, микроцефалия – у половины больных, выступающая коробкообразная лобная часть – в 3/4 случаев, уплощение носа – у 70 % пациентов, слабо выраженное косоглазие – у 2/3 больных, удлиненные глазные щели и голубые склеры – в 60 % случаев, значительное укорочение носа – у 2/3 обследованных. В основном дети умирают от ВИЧ—эмбриопатий. Более благоприятно протекает заболевание у детей, которые подверглись инфицированию в возрасте старше 1 года, чаще это пациенты, зараженные в ходе проведения переливаний крови или инъекций. СПИД у них развивается через 5,5–7 лет после заражения, диагностируется заболевание обычно через 17 месяцев. Клиника болезни также отличается от взрослых: вместо пневмоцистной пневмонии чаще встречается лимфоидная интерстициальная пневмония (ЛИП), течение которой доброкачественнее. Для этих больных наиболее часты такие вторичные инфекционные заболевания, как грибковое поражение полости рта и пищевода, инфекция, вызванная вирусом Эпштейна—Бара, и другие вторичные поражения. Время присоединения суперинфекций значительно влияет на характер течения и выраженность клиники у больного ребенка. Для детей с рано выявленными персистирующим кандидозным стоматитом, эзофагитом, пневмоцистной пневмонией показатель выживаемости составляет в среднем около 1 года, в то время как у детей с повторными бактериальными инфекциями или ЛИП этот период колеблется от 50 до 77 месяцев. Персистирующее распространенное поражение лимфоидного аппарата, увеличение селезенки, снижение массы тела, лихорадка, диарея, отставание в психомоторном развитии, уменьшение количества тромбоцитов с геморрагическими проявлениями, анемия являются наиболее частыми признаками как врожденной, так и приобретенной ВИЧ—инфекции у детей. Вследствие подавления иммунной системы значительно возрастает восприимчивость организма ребенка к различным инфекциям, течение их затягивается: дети чаще страдают от ОРВИ, у них весьма часто возникают тяжелые бактериальные инфекции со склонностью к затяжному, длительному рецидивирующему течению и генерализации инфекции. Нередко встречаются герпетическая инфекция и токсоплазмоз. Хотя у таких больных реже отмечается микобактериоз, криптоспоридиоз и криптококкоз, однако чаще имеют место поражения кожи и слизистых оболочек грибковыми микроорганизмами, в особенности это относится к развившемуся СПИДу. Почти каждый второй ребенок страдает бактериальными инфекциями, у них встречаются гнойный отит, менингиты, наблюдаются тяжелые гнойные поражения кожи при сопутствующей экземе, типичны массивные бактериальные пневмонии с абсцедированием и выпотом в плевральную полость, неоднократные эпизоды бактериального сепсиса, встречается бактериальная инфекция костей, суставов. Возбудители этих процессов – стафилококки, пневмококки, Haemophilus influenzae, сальмонеллы, различные грамотрицательные микроорганизмы, в том числе склонные к внутрибольничному распространению. Такие вторичные поражения настолько характерны, что многие отечественные и зарубежные авторы включают их в группу СПИД—ассоциируемых суперинфекций. Таким образом, вторичные инфекционные заболевания у детей являются основными причинами заболеваемости и смертности в отличие от взрослых, у которых вторичные инфекции являются частью вторичных осложнений. Такое течение заболевания напоминает клиническую картину у больных с уменьшением количества альбуминов крови. На основании этого вторичные инфекции у детей были включены в список «индикаторных» болезней, при которых вероятность диагноза ВИЧ—инфекции чрезвычайно высока. Но это более характерно для детей, инфицирование которых произошло только внутриутробно. У детей, инфицированных внутрибольнично, особенностью клинической картины является более быстрое прогрессирование патологического процесса в виде преобладания клинически выраженных стадий ВИЧ—инфекции по сравнению с взрослой группой больных ВИЧ. В момент постановки диагноза у 50 % больных детей преобладала клиника вторичных заболеваний, в то время как среди взрослых в стадии вторичных заболеваний находилось только 10 %. Скорее всего, это связано с поступлением большого количества возбудителя одномоментно, ранним возрастом больного в момент заражения и тяжелым преморбидным фоном. Особенности патогенеза ВИЧ—инфекции у детей, развившейся на фоне существовавшей иммуносупрессии, проявились уже в самом начале заболевания – в момент диагностики стадий процесса. Так, треть детей в исследуемой группе уже были в фазе IIB – IIIA и около 20 % – на более поздних стадиях болезни. Характерные для взрослых виды сопутствующих инфекций у детей с ВИЧ—инфекцией развиваются на фоне вторичных бактериальных инфекций. Манифестация клиники оппортунистической инфекции у детей происходит значительно раньше, чем у взрослых, этому в значительной мере способствует наличие бронхолегочной патологии. После парентерального инфицирования ВИЧ в исследуемой группе суперинфекция развилась у 60 % детей в течение 3 лет. По мере прогрессирования заболевания частота и разнообразие поражений нарастают: наиболее интенсивное развитие оппортунистических инфекций наблюдалось на первом году болезни, почти 30 % больных перенесли те или иные заболевания, и у 20 % больных суперинфекция развилась на втором году с начала заболевания. По данным многих исследований, у больных ВИЧ—инфекцией детей характерными являются инфекции: пневмоцистная пневмония, кандидоз пищевода, генерализованный ток—соплазмоз, криптококкоз, цитомегаловирусная (CMV), герпетическая (HSV) инфекции и заболевание, вызванное вирусом Эпштейна—Барра (EBV). Из злокачественных новообразований особенно характерны саркома Капоши, возможны также карциномы, В—клеточные лимфомы и др. В то же время среди суперинфекций практически отсутствуют часто встречаемые у взрослых больных различного рода паразитозы. Как показал анализ наших исследований, лидирующей патологией являются заболевания, вызванные вирусом простого герпеса. На заболевания, вызванные HSV, в структуре всех суперинфекций у детей приходится 22,9 %, на заболевания, этиологически связанные с вирусом Herpes Zoster (герпес Зостер), – 8,15 %, CMV – инфекция составляет 23,7 %. Но клинически выраженные проявления этой инфекции у детей составили 9,1 %, субклинические формы болезни – 14,6 %. К группе герпесвирусных относится лимфоидная интерстициальная пневмония, этиологическим фактором которой является вирус Эпштей—на—Барра. Помимо вирусных заболеваний у детей нередко присоединяется грибковая инфекция, ее доля в общей массе инфекционных поражений составляет около 1/4 среди суперинфекций (24,7 %). Основным возбудителем являются грибы рода Кандида, поражающие кожу с ее придатками, желудочно—кишечный тракт и мочеполовую систему. Удельный вес простейших в общей массе суперинфекций невелик, на них приходится всего около 12 % случаев осложнений. Наиболее часто встречается токсоплазмоз, протекающий в основном в скрытой форме, и пневмоцистоз. Наиболее редкими осложнениями у ВИЧ—инфицированных больных остаются проявления неопластических процессов. Таким образом, ведущим в поражении ребенка ВИЧ является бактериальный бронхолегочный компонент, к которому присоединяются столь характерные для больных ВИЧ/СПИД сопутствующие поражения вирусами, простейшими, грибами и микобактериями, которые, в свою очередь, определяют клинические особенности заболевания в каждом конкретном случае, тяжесть течения и исход болезни. На начальных этапах заболевания наиболее частыми причинами развития сопутствующих инфекционных осложнений становятся вирусы семейства Herpes viridae и грибы рода Кандида. В клинике заболеваний хронические формы течения преобладали над острыми проявлениями. Более 2/3 пациентов в течение 2 лет после инфицирования имели картину хронической герпетической инфекции. Нередким является поражение цитомегаловирусом, однако с меньшими выраженностью и интенсивностью. Всего паротит CMV – этиологии наблюдали у 13,5 % больных ВИЧ—инфекцией детей. По мере прогрессирования заболевания все клинические случаи перешли в хроническую форму с 2–кратными, реже – 3–кратными обострениями в год. В свете изложенного заболевания, вызываемые герпес—вирусами, следует расценивать как начальные признаки инфицирования вирусом иммунодефицита человека детей с бронхолегочной патологией бактериальной этиологии. В течение первого года после инфицирования они присоединяются более чем в трети всех случаев, на третьем году поражают около половины всех заболевших. Тем не менее в ходе исследований выяснилось, что у 50 % заболевших детей кожные проявления инфекции герпес Зостер развивались лишь к 5–8–му году после заражения. Ведущей причиной смерти детей с синдромом приобретенного иммунодефицита являются поражения легких, основным возбудителем которых считается пневмоциста каринии. Часто встречающимся клиническим вариантом воспаления легких является лимфоцитарная интерстициальная пневмония (ЛИП), остающаяся патогномоничным осложнением у детей, пораженных вирусом иммунодефицита человека. Этиология пока не установлена. При микроскопическом исследовании выявляется массивный выход и скопление в интерстиции и околобронхиальных зонах плазматических клеток, лимфоцитов, незрелых форм иммунокомпетентных клеток. В дифференциальной диагностике лимфоцитарно—интерстициальной и пневмоцистной пневмоний важным моментом является клиническая картина. Для ЛИП характерно постепенное медленное начало заболевания, выраженность сухого кашля, смешанной одышки нарастает, больных также беспокоит повышение температуры тела до 37–37,8 °C. При этом аускультативно в легких не отмечается каких—либо нарушений, кроме амфорического дыхания. Типичных для других форм пневмонии влажных хрипов нет. Еще одной частой причиной развития воспаления легких у детей, пораженных ВИЧ, является грибковая инфекция, поражающая 1 из 5 больных в течение 1–го года после заражения, у 50 % больных это осложнение сопровождалось проявлениями кандидоза на коже. Фактически все случаи хронического поражения кожи и слизистых у ВИЧ—инфицированных детей (91,5 %) впервые проявились как острые формы на 1–3–м году с момента инфицирования. Редким в детском возрасте является инфицирование плесневыми грибами и грибами рода Criptococcus. Редким осложнением на первом году после заражения считается и инфекция микобактерией туберкулеза, которая поражает больных чаще через 2–3 года после заражения. Осложнения неопластического характера среди больных ВИЧ в детском возрасте практически не встречаются. Пневмоцистная пневмония относится к наиболее характерной в СПИД—индикаторной патологии у взрослых. Она присоединяется в период, когда явления иммунодефицита значительно выражены. В таблице 3 представлены возбудители, наиболее часто являющиеся причиной осложнений у ВИЧ—инфицированных детей и взрослых. Основные различия связаны с чрезвычайно высокой частотой развития у детей рецидивирующих бактериальных инфекций и патологией, вызванной герпес—вирусами, достигающих 100 % у больных ВИЧ/СПИДом детей. У детей бактериальные инфекции являются основными проявлениями клинической симптоматики и причиной смертности в отличие от ВИЧ—инфицированных взрослых, среди которых бактериальные инфекции выявлены только у 32,5 % больных и представляют небольшую часть от всего спектра СПИД—ассоциируемых заболеваний. Основными проявлениями рецидивирующих бактериальных инфекций у ВИЧ—инфицированных детей является патология со стороны легочной системы в виде хронических пневмоний (72,3 %), хронических бронхитов (21,5 %), бронхоэктатической болезни (12,2 %). 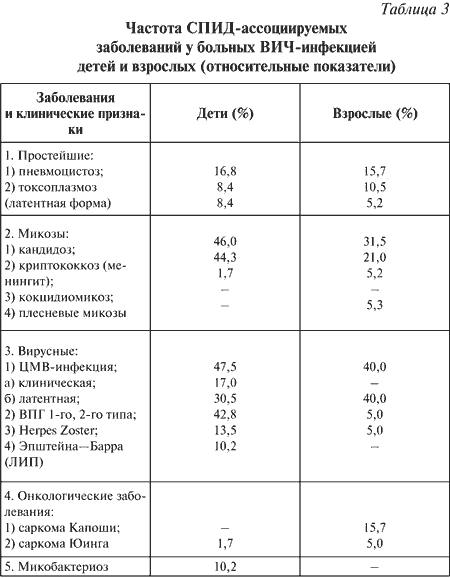 Другими характерными признаками персистирования в организме ребенка вируса иммунодефицита человека остаются уменьшение массы тела (симптом имеет клиническую весомость особенно в тех случаях, когда дефицит массы тела превышает 1/10; на поздних же этапах типичным признаком ВИЧ—инфекции является кахексия), патологические изменения лимфатических узлов (увеличение и гиперплазия фолликулов, выраженность которых варьирует в зависимости от стадии заболевания), увеличение в объеме печени и селезенки, что может наблюдаться уже на начальных этапах заболевания. 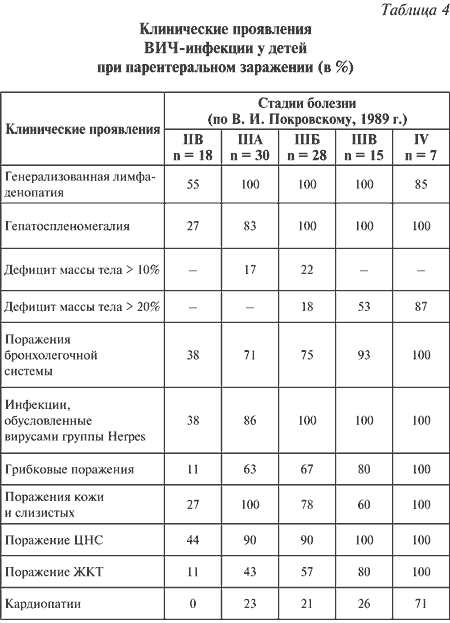 Частым возбудителем инфекционных осложнений с поражением желудочно—кишечного и мочеполового трактов, внешних покровов являются грибы рода Кандида. Они могут также поражать слизистую оболочку ротовой полости, глотку и гортань. По мере прогрессирования заболевания его течение принимает системный, распространенный характер. У взрослых кандидоз развился у 21 % больных в виде поражений ЖКТ и влагалища. Значительный рост кандидозного поражения желудочно—кишечного тракта начинается со стадии IIIA – почти у 2/3 диагностирован кандидоз желудочно—кишечного тракта, с такой же частотой (2/3 больных детей) он выявлен в стадии ШБ, в стадии IIIB – уже у 3/4 детей и в терминальной стадии заболевания – у всех больных детей. Проявления кожной патологии выявляются в стадии IIIA в 100 % случаев, в стадии ШБ – в 78 % и в терминальной стадии – у всех детей. Часто наблюдаются на коже и ее придатках хронические персистирующие инфекционные процессы грибковой и бактериальной природы. Кандидозы кожи имеют место почти у 25 % больных детей, себорея встречается у них реже, наблюдается преимущественно на начальных стадиях инфекции. Также для ранних периодов течения СПИДа типичны выраженные и распространенные гнойничковые поражения кожи, чего практически не наблюдается на поздних стадиях. Весьма распространенным сопутствующим поражением кожи и слизистых оболочек остаются язвенно—некротические дефекты, возникающие, как правило, в терминальной стадии. Они представляют собой язву до 2 см в диаметре, не заживающую в течение продолжительного периода времени. Такие явления настолько часто встречаются у пораженных СПИДом, что их появление указывает на его наличие почти в 100 % случаев. Частым поражением, сопутствующим СПИДу, является волосатая лейкоплакия языка. Со стороны центральной нервной системы при поражении ВИЧ имеют место неспецифические проявления, протекающие по типу астеноневротического и цереброастенического синдромов. Они встречаются в основном на начальных этапах заболевания чуть менее чем у половины пораженных и почти у всех больных – в терминальной стадии. Кроме того, на поздних стадиях возможно присоединение энцефалопатии, а также энцефалитов, что ведет к необратимым органическим повреждениям в центральной нервной системе и нередко становится причиной летального исхода заболевания. 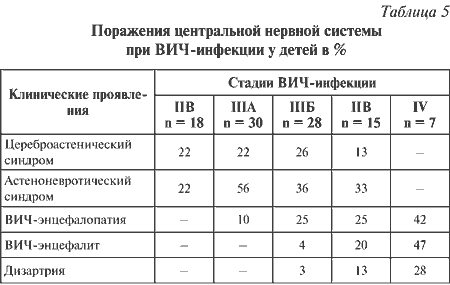 Состояние желудочно—кишечного тракта тоже страдает, причем не только вследствие поражения ВИЧ и присоединения вторичных инфекций, но и из—за действия антиретровирусных, антибактериальных, противогрибковых препаратов, применяемых для лечения. Так, если на ранних этапах процесса в стадии ИВ, когда еще не присоединилась оппортунистическая инфекция и не проводилась массивная лекарственная терапия, лишь у каждого десятого ребенка имелись симптомы поражения желудочно—кишечного тракта (ЖКТ). В стадии IIIA патология желудочно—кишечного тракта обнаруживается чуть менее чем у половины больных детей, в стадии ШБ – более чем у половины, в стадии СПИДа – у 4/5 всех заболевших и в терминальной стадии – у 100 % пораженных. Основным проявлением нарушения функций пищеварительной системы являются проблемы, связанные с дисбактериозом кишечника, что выражается в наличии частого жидкого стула с остатками непереваренной пищи, высокими показателями обсеменения патогенными и условно—патогенными микроорганизмами. С развитием процесса ВИЧ—инфекции в организме ребенка нарастает интенсивность применения антибактериальных препаратов и других лекарственных средств, поэтому увеличивается количество детей с этим видом патологии: в стадии IIIA – у каждого пятого, в стадии ШБ – у каждого третьего, в стадии ШВ – в 60 %, в терминальной стадии – у всех детей. Очередным органом, который поражается при ВИЧ—инфицировании, является печень, часто поражаемая вирусами гепатита В и С. В клинике имеют место синдромы гепатомегалии и спленомегалии, возможны проявления цитолиза с выходом печеночных трансаминаз в кровь, однако уровень билирубина при этом практически не изменяется и желтуха, как правило, не развивается. В крови характерно наличие типичных серологических маркеров. Однако антитела к вирусам гепатита В и С у ВИЧ—инфицированных детей не определялись на ранних стадиях заболевания, хотя проводилось регулярное тестирование, первые положительные результаты получены через 2–3 года от момента инфицирования. Однако в целом среднетяжелые и тяжелые осложнения со стороны желудочно—кишечного тракта у пораженных ВИЧ в детском возрасте отмечаются редко. Поражение мочевыделительной системы у ВИЧ—инфицированных детей находит отражение, как правило, в выделении большого количества белка с мочой. Нефротический синдром является проявлением воспалительных изменений в чашечно—лоханочной системе и длится довольно долго. На поздних стадиях явления хронического пиелонефрита уступают место признакам поражения клубочкового аппарата почек.  Так как на данное время у исследователей не имеется убедительных клинических данных, говорящих за эффективность антиретровирусной терапии у детей до 1 года, то вопрос о ее назначении решается индивидуально в отношении каждого конкретного пациента на основании имеющихся клинических проявлений, их степени выраженности, значения лабораторных показателей и т. д. ПРИНЦИПЫ ЛЕЧЕНИЯ Схемы терапии Выбор схемы лечения зависит от многих факторов, среди которых возраст пациента, тяжесть течения заболевания и т. д. Лечение одним препаратом считается в большинстве случаев неэффективным и вызывает развитие устойчивости. Использование 2 НИОТ для комбинированной АРТ (зиновудин и диданозин или зиновудин и зальцитабин) показано в первую очередь пациентам с умеренно выраженным уменьшением числа Т—лимфоцитов—хелперов до 0,20—0,35 на 109/л (200–350/мкл) и во всех остальных случаях, когда показана комбинированная АРТ, а возможности для применения трех антиретровирусных препаратов нет. Высокоактивная антиретровирусная терапия. Использование 3– или 4–компонентных схем носит название высокоактивной антиретровирусной терапии (ВААРТ). Внедрение в клиническую практику трехкомпонентной АРТ позволило добиться уменьшения вирусной нагрузки ниже уровня определения, а также повышения числа Т—лимфоцитов хелперов у большинства пациентов. Оценка эффективности высокоактивной терапии Эффективность высокоактивной терапии оценивается по изменению клинического состояния пациента, числа Т—лимфоцитов—хелперов и уровня вирусной нагрузки. О неэффективности высокоактивной терапии свидетельствуют появление РНК ВИЧ после его отсутствия у ранее не леченных пациентов или повышение уровня вирусной нагрузки по сравнению с наименьшим уровнем, если пациенты ранее получали АРТ. Неэффективность лечения может быть связана не только с пропуском приема лекарственных препаратов, но еще с неточным выполнением инструкции по их использованию. 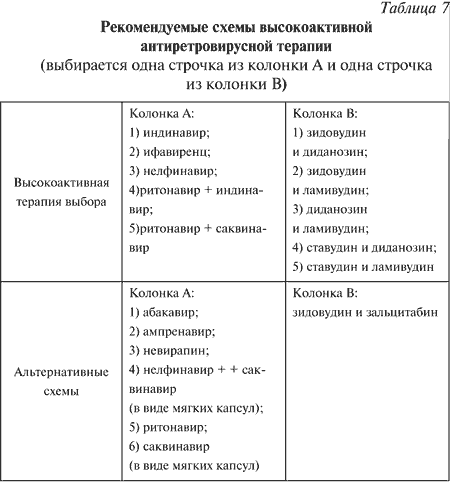   Если проводимая терапия не приводит к значительному улучшению состояния, отсутствуют лабораторные изменения, говорящие в его пользу, целесообразно заменить препарат, к которому имеется резистентность, или, если нет возможности выявить этот препарат, назначить другую схему лечения.  Химиопрофилактика перинатальной передачи ВИЧ—инфекции. Варианты назначения химиопрофилактической терапии В случае если женщина с ВИЧ—инфекцией никогда раньше не принимала антиретровирусных препаратов, следует использовать следующий алгоритм действий.  Если же женщина принимает в данный момент препараты АРТ.  Если ВИЧ—инфицированная беременная женщина в родах и не получала ранее АРТ.   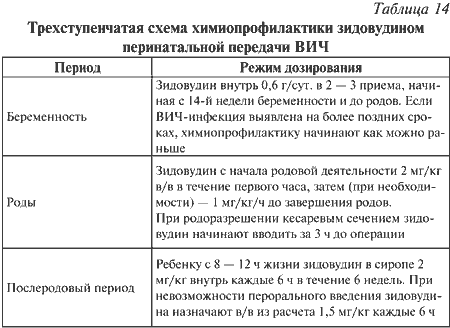 ВЕРОЯТНЫЕ ИСХОДЫ ВИЧ—ИНФЕКЦИИ У ДЕТЕЙ Приведенные данные свидетельствуют о значении возраста ребенка во время инфицирования как прогностического признака тяжести развития ВИЧ—инфекции, а также показывают роль временного фактора. Наиболее часто болезнь развивалась довольно быстро, отягощалась присоединением разнообразных осложнений с выраженной клинической картиной, хотя имели место и вялотекущие случаи без особой симптоматики, не требующие специфического лечения. Это наглядно демонстрирует следующее наблюдение. Анализ летальности в группе парентерально инфицированных ВИЧ детей показал зависимость ее от возраста ребенка, при котором произошло инфицирование. Всего за 8 лет наблюдения умерли 28 человек (43 %), почти треть детей умерли в течение первого года от момента инфицирования. Наибольшая доля летальных исходов (около 86 %) приходится на парентеральное заражение детей в возрасте до 1 года. 1/5 детей, которые инфицировались в возрасте от 4 до 6 лет, в течение 8 лет умерли. При заражении в возрасте от 7 до 14 лет этот показатель выше – 30 %. Таким образом, прослеживается четкая зависимость летальности в возрастных группах больных ВИЧ—инфекцией от возраста при инфицировании. ГЛАВА 2. СИФИЛИС Сифилис – общее инфекционное хронически протекающее венерическое заболевание, возбудителем которого является микроб – бледная трепонема, с преобладанием полового пути передачи возбудителя, хотя возможны и довольно распространены бытовой и трансплацентарный (внутриутробный) пути заражения. Заболевание носит рецидивирующий характер течения, симптомы его развиваются строго соответственно определенным периодам болезни. При сифилисе поражается не только кожа, но практически все органы и системы, что ведет к значительным нарушениям их функций и чревато смертельными исходами. В вопросе об источнике сифилиса имеется несколько точек зрения: 1) завезен в Европу из Америки участниками экспедиций Христофора Колумба, которые, в свою очередь, заразились им от местных жителей (на сегодняшний день практически отвергнута в связи с тем, что имеются данные о заболеваемости европейцев сифилисом в более ранние периоды истории); 2) аналогична первой, однако источником полагается экваториальная Африка; 3) изначально присутствовал на всех континентах. ПРИЧИНЫ И МЕХАНИЗМЫ РАЗВИТИЯ Возбудителем сифилиса является спирохета Ээндемическая ее, подвид Т. pallidum. В благоприятных условиях размножается путем двойного поперечного деления за 32 ч. Возбудитель сифилиса может существовать в следующих формах: 1) цистовая (микроорганизм принимает форму клубка, плотно сворачиваясь, и синтезирует вокруг себя плотную непроницаемую оболочку – цисту); в таких случаях для лечения следует использовать большие дозы антибиотиков, которые могут перевести цистовую форму существования микроорганизма в обычную; 2) L – форма; 3) зернистые формы. Воздействие низких температур переносит довольно хорошо и может сохраняться длительно, зато высокочувствительна к высоким температурам высушиванию, ультрафиолетовому облучению, действию простейших дезинфицирующих средств. Заражение сифилисом происходит тогда, когда имеется источник, возбудитель, входные ворота для инфекции. Основным источником инфекции является больной сифилисом человек, особенно заразны люди, у которых наличествуют активные проявления свежего сифилиса на внешних покровах и слизистых оболочках. Более всего заразны и опасны влажные высыпания на коже, которые носят мокнущий характер, в биологической жидкости, которая отделяется с этих очагов, находится огромное количество возбудителей сифилиса. Передается возбудитель многими путями, основным из которых является половой контакт с больным 85–90 % среди всех случаев заражения; по эпидемиологическим данным, заражение во время полового акта происходит примерно в 30 % случаев. Основная масса исследователей полагают, что бледная трепонема не может проникнуть сквозь неповрежденную кожу или интактные слизистые, и большинство случаев инфицирования развивается при наличии видимых или микроскопических нарушений их целостности. Возможен также бытовой путь заражения сифилисом через предметы домашнего обихода (при пользовании общей посудой, бельем, полотенцами и даже при курении одной сигареты). Возможна также передача возбудителя от матери плоду во время беременности – заражение происходит внутриутробно – через сосуды плаценты, при переливании крови и ее компонентов, при инъекциях нестерильными шприцами. В организме бледные трепонемы активно размножаются, могут распространяться с током лимфы, гематогенно, по периневральным пространствам, возбудитель заносится в разные органы и ткани, что обусловливает те или иные признаки заболевания. По истечении некоторого времени количество микроорганизмов—возбудителей сифилиса в организме больного снижается, однако наряду с этим имеет место и сенсибилизация тканей организма. Ткани отвечают на контакт с возбудителем более бурно, ярче выражен аллергический компонент. В связи с этим изменяются клинические проявления патологического процесса на каждом конкретном этапе протекания инфекции. В большинстве случаев после попадания возбудителя в организм наблюдается классическое протекание сифилитической инфекции, отмечается типичная периодика и стадийность процессов. Тем не менее в отдельных случаях возможно и длительное (многолетнее) бессимптомное течение без ярко выраженной клинической картины. В случаях с такой стертой клиникой впоследствии бессимптомное течение болезни начинает проявляться и поражает внутренние органы и нервные структуры. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ Клиническая картина сифилиса разнообразна и насыщена, развитие и выраженность ее проявлений зависит от проводимой терапии. Если заболевший не получает никакого лечения, то в ходе заболевания выделяют следующие периоды. 1. Инкубационным периодом называют время, прошедшее от момента проникновения возбудителя в организм до появления на теле первого клинического симптома – твердого шанкра. Длительность инкубационного периода при сифилисе составляет в среднем 20–40 дней (возможны вариации от 10 до 90 дней). В ходе проведения опытов было доподлинно установлено, что время появления первичного шанкра находится в прямо пропорциональной зависимости от количества попавших в организм возбудителей. В среднем этот период составляет около трех недель. Типичный гунтеровский шанкр (назван по фамилии впервые описавшего его ученого) возникает строго на месте внедрения бледных трепонем в организм и представляет собой безболезненную язву овальной блюдце—образной формы с дном красновато—синего цвета, плотным инфильтрированным краем и скудным отделяемым. Размер ее непостоянен и может составлять от нескольких миллиметров до нескольких сантиметров в диаметре. Затем в течение первых нескольких часов микроорганизмы с током крови и лимфы попадают в регионарные лимфатические узлы, вызывая их воспаление регионарный лимфаденит, он может быть односторонним и двусторонним и имеет место у 50–85 % больных. Явления регионарного лимфаденита становятся хорошо выраженными через неделю после появления первичной язвы. Примерно в половине случаев шанкр может быть атипичным: иметь мягкую, неуплотненную консистенцию, быть болезненным, возможно присоединение вторичной инфекции или развитие множественных язв, возможно внутреннее расположение шанкра, описаны случаи течения сифилиса без появления первичного твердого шанкра. 2. Первичным периодом сифилиса называют промежуток времени от возникновения твердого шанкра до развития первого генерализованного высыпания. Его длительность составляет 6–8 недель. Типичны три симптома: твердый шанкр, воспаление регионарных лимфатических узлов и мелких лимфатических сосудов – регионарный лимфангиит. При этом лимфатические узлы неравномерно увеличены в размерах, подвижны, безболезненны, плотноэластической консистенции, нагноительные явления нехарактерны, хотя возможно небольшое временное повышение температуры, слабость и головокружение. Тем не менее эти явления быстро стихают. Состояние, при котором у больного развивается острая лихорадочная реакция, пациент испытывает сильный озноб, слабость, недомогание, головную боль и головокружение, боли в горле, сопровождающиеся местным воспалением зон кожи и слизистых, где произошло внедрение возбудителя, называется реакцией Яриша—Герксгеймера. Она развивается обычно по прошествии нескольких часов после начала лечения сифилиса. Наблюдается у половины больных первичным сифилисом и 3/4 больных вторичным сифилисом, а также одной трети больных с нейросифилисом. Имеются свидетельства о том, что реакция Яриша—Герксгеймера развивается в ответ на высвобождение липополисахаридов из бледных трепонем, которые действуют как бактериальный эндотоксин. Для постановки диагноза одной только клинической картины недостаточно, а поскольку получить культуру не представляется возможным из—за плохого роста бледной трепонемы на средах, то ведущим методом в диагностике сифилиса становится микроскопия отделяемого с шанкра в темном поле. Может также быть использовано аспирированное содержимое увеличенного лимфатического узла. Отрицательный результат может быть убедительным лишь в том случае, если он получен как минимум троекратно при проведении ежедневного исследования на протяжении трех суток. В противном случае отрицательные пробы в количестве менее трех не имеют под собой диагностической значимости и не могут быть основанием для снятия диагноза сифилиса. Полезными и информативными методами диагностики первичного сифилиса являются исследование биоптата из области первичной язвы. Из этой области можно так же взять материал на микроскопию. Распространенным способом диагностики считается реакция Вассермана и реаниновая экспресс—проба, а также реакция на основе абсорбции флюоресцирующих спирохетозных антител. Нарастание титра антител в этих пробах свидетельствует о высокой вероятности диагноза сифилиса. Эти исследования обычно проводятся еженедельно не менее одного месяца. Первичный сифилис лечат наиболее часто препаратами пенцилинового ряда. Альтернативным препаратом считается тетрациклин. Чтобы избежать неудач в лечении первичного сифилиса, рекомендуется повторное проведение сывороточных реакций дважды после окончания курса лечения с интервалами в три месяца. При этом титры антител должны уменьшиться как минимум в четыре раза. 3. Второй период характеризуется тем, что картина генерализованного высыпания уступает место бугоркам или гуммам. Эти элементы обобщенно называют третичными сифилидами (т. е. появляющиеся во время третьей по счету фазы заболевания). Около половины пациентов в этот период заболевания испытывают слабость и недомогание (23–46 %), частым симптомом при вторичном сифилисе является головная боль (9—46 %), повышение температуры тела и явления озноба сопровождают течение заболевания в 5—39 %, зуд отмечают чуть меньше половины больных (42 %), четверть пациентов предъявляют жалобы на потерю аппетита. Значительно реже встречаются такие симптомы, как болезненность в глазных яблоках при их движениях, болезненные ощущения в костях и суставах, хрипота, менингиальные симптомы, воспаление радужки. Этот период довольно продолжителен и длится 3–4 года, течение его волнообразно и изобилует разнообразием клинических симптомов. Основной орган, отображающий происходящие в организме процессы, – кожа, хотя могут поражаться все органы и системы. Гуммы образуются при проникновении возбудителя из системного кровотока в слои кожи. Твердый шанкр сменяется появлением генерализованной сыпи на 2–3 месяца, которая в свою очередь уступает место гуммам, затем все проявления исчезают на некоторое время и вскоре возобновляются в той же последовательности, исключая появление твердого шанкра. Первая волна высыпаний обычно наиболее выражена. Во вторичном периоде выделяют пять различных групп сифилидов: сифилитическая розеола, сифилитические папулы, лейкодерма сифилитическая, сифилитические пустулы, сифилитическая плешивость. Их примерное внешнее строение нужно знать для более легкого выявления больных сифилисом и для проведения дифференциальной диагностики. Розеолы представляют собой пятна, локализующиеся, как правило, на кожных покровах туловища, их цвет бледно—розовый, форма округлая, поверхность не шелушится. Папулы внешне напоминают гладкие узелки округлой формы сине—красного цвета, вегетирующие в складках кожи и в области заднего прохода, сифилитические папулы приобретают название «остроконечные кондиломы». Пустулы при сифилисе мало чем отличаются от обычных гнойничковых заболеваний кожи, со временем они изъязвляются, но могут покрываться гнойными корочками. Плешивость проявляется потерей волос, что носит очаговый характер и не сопровождается какими—либо изменениями со стороны кожи. Сифилитической лейкодермой называют участки кожи с гипопигментацией в форме пятен или по типу кружев, в основном этот элемент проявляется на шее. При внедрении возбудителя в слизистую оболочку зева возможно развитие его воспаления (ангины сифилитической), что встречается довольно часто. По морфологической картине такие ангины могут быть гнойничково—язвенными, папулезными, эритематозными. Клинически сифилитические ангины можно отдифференцировать от обычных стрептококковых на основании отсутствия резких воспалительных проявлений в виде повышения температуры тела, ознобов, болей и т. д. Если сифилитические высыпания затрагивают голосовые складки, голос больного становится охриплым или осиплым. Нечасто встречаются патологические изменения со стороны костной системы в виде воспалительных реакций в костной ткани и надкостнице. При этом чаще поражаются большие и малые берцовые кости. Осложнения проявляются болевыми ощущениями преимущественно в ночное время суток, оно может протекать по типу артрита как изолировано, так и поражать несколько суставов. В процесс могут вовлекаться и синовиальные влагалища мышц, воспаление сопровождается скоплением жидкости в синовиальных пространствах суставов. Наряду с поражениями костной системы встречаются и нарушения функции печени, желудка, кишечника, почек, воспаления нервов. При постановке диагноза вторичного сифилиса необходимо уделить достаточно внимания дифференциальному диагнозу, так как именно на этом этапе течения сифилиса встречается больше всего неточностей и неверных заключений. Для того чтобы отличить сифилитическую розеолу от элементов розеолезной сыпи, развивающейся при тифах, необходимо обратить особое внимание на ее распространенность и наличие шелушения, которые типичны для поражения сифилисом, наличие точечных кровоизлияний и петехий, наоборот, более характерно для других заболеваний. Кроме того, на коже обычно вдобавок к сыпи имеются вторичные изменения, называемые сифилидами. Четкое указание в анамнезе на предшествующее употребление каких—либо лекарственных или химических веществ заставляет больше задуматься о токсикодермиях, нежели о сифилитических проявлениях. Также для таких явлений более характерен аллергический оттенок реакции: шелушение элементов, чувство зуда и жжения. Клиническая картина описанных проявлений довольно быстро сворачивается при отмене препарата, прекращении поступления в организм триггерного агента. Определяющим методом диагностики является постановка сывороточных реакций, наиболее популярной из них остается реакция Вассермана. В то время как кожные проявления вторичного сифилиса могут протекать нетипично, имитировать течение других заболеваний, сывороточные тесты практически всегда дают определенный ответ на вопрос, касающийся присутствия в организме возбудителя сифилиса, что не вполне характерно для первичного периода заболевания. Ложноотрицательные результаты могут встречаться при развитии феномена прозоны, когда титры антител настолько высоки, что реакция «антиген-антитело» не протекает в полном объеме. Если такую сыворотку немного развести, то можно получить желаемый положительный результат. Лечение вторичного сифилиса проводится по тем же принципам, что и первичного. Примерно на третьем году течения заболевания вторичный сифилис переходит в третичный. Если больной не получает адекватного лечения, третичный период сифилиса затягивается и может длиться всю оставшуюся жизнь. Это наиболее тяжелый период для пораженного, уродующий его физически, приводящий к инвалидизации и в некоторых случаях к смерти. Благодаря значительным успехам в совершенствовании методов диагностики ранних форм сифилиса, отработанным схемам лечения и появлению новых высокоэффективных препаратов, на сегодняшний день это заболевание в третичном периоде практически не встречается. На поздних стадиях сохраняется тенденция к волнообразному течению, однако продолжительность каждого последующего рецидива удлиняется; количество микроорганизмов в покровных тканях значительно уменьшается, из—за чего велика вероятность получения ложноотрицательных результатов при проведении серологических исследований, а заразность больного для окружающих сводится почти к нулю. Наиболее подвержены повреждающему действию инфекции в третичном периоде кожа, слизистые оболочки, костные образования. Элементами третичного периода, являющиеся визитной карточкой этой фазы течения сифилиса, являются бугорки, которые в большом количестве образуются в толще кожи, безболезненные. Спустя некоторое время на их месте появляются мелкие язвочки, которые затем организуются в маленькие рубчики или пигментные пятнышки. Они плотные по консистенции, сине—красные, с гладкой поверхностью, часто их сравнивают с вишневыми косточками. Второй элемент, характерный для третичного периода сифилиса, – сифилитическая гумма. Основное место локализации – кожа голеней и предплечий, слизистые языка, зева, носа, реже – кожа головы. Гумма выглядит как узел, располагающийся в глубине подкожно—жировой клетчатки, при пальпации он безболезненный. Он также имеет сине—красный цвет и округлую форму, по величине как грецкий орех, однако на ощупь имеет эластичную структуру. Гуммы склонны к болезненным изъязвлениям с формированием в их центре некротического стержня. Организующиеся язвы оставляют после себя рубцы с неровными краями в форме звезды. Прорастая в подлежащие ткани, они искажают процесс звукообразования в гортани, глотание, дыхание, способствуют деструкции костных элементов носовой перегородки, что приводит к изменению формы носа, который западает и становится седловидным. Если во время беременности мать будущего ребенка заражена сифилисом, то его возбудитель с током крови через сосуды плаценты проникает в организм плода по пупочной вене. При этом велика вероятность выкидышей, внутриутробной гибели плода. Различают ранний сифилис, развивающийся в возрасте до четырех лет, и поздний, если заражение произошло позднее. К раннему врожденному сифилису относятся также следующие периоды, отличающиеся клинически друг от друга: сифилис плода, если ребенку меньше года, то это сифилис грудного возраста, если больше года, но меньше 4 лет, то это сифилис раннего детского возраста. Для сифилиса плода характерно начало патологических процессов примерно с середины беременности. При этом страдают внутренние органы, опорно—двигательный аппарат плода, что проявляется появлением фокусов воспаления в тканях, заменяющихся затем элементами соединительной ткани. Это может серьезно нарушать функции соответствующих органов и приводить к гибели плода. Наиболее часто поражаются печень, селезенка и трубчатые кости. Для врожденного сифилиса грудного возраста характерны как общие признаки: дистрофические явления с повышениями температуры тела, потливостью, тревожностью и беспокойностью ребенка, – так и развитие повреждений и патологии развития во внутренних органах. К ним относятся поражения печени, патология почек, пневмонии, воспаления костной ткани и повреждения хрящевых структур. Кроме того, он проявляется наличием обильной сыпи на коже и слизистых, представленной разнообразными элементами. Картина высыпаний во многом сходна с таковой при клинике вторичного периода. Тем не менее имеется у детей и ряд особенностей: папулезные высыпания носят эрозивный характер, имеют влажную мокнущую поверхность. В околоротовой области могут образовываться так называемые диффузные инфильтрации Гохзингера, которые представляют собой сливающиеся папулезные элементы, трескающиеся по мере подсыхания. Подобные элементы, возникающие на слизистой оболочке носа, впоследствии покрываются корками. Это обстоятельство значительно затрудняет ребенку процесс дыхания, из—за чего он становится раздражительным или пассивным, тревожным, беспокойным, из—за трудностей с сосанием груди затруднен процесс кормления. На ладонях и подошвах стоп могут появляться гнойничковые высыпания. При врожденном сифилисе раннего детского возраста основными патологическими проявлениями остаются поражения кожных покровов, слизистых и костной системы. Высыпания менее обильны, локализованы, сходны с таковыми при вторичном рецидивном сифилисе (часто встречаются широкие кондиломы, выпадение волос). Сифилис, проявляющийся в промежуток от 5 до 17 лет, называют поздним врожденным. Симптомы и признаки, характерные для этой формы заболевания, напоминают таковые при третичном сифилисе. Тем не менее выделяют ряд признаков, патогномоничных для позднего врожденного сифилиса. Среди них выделяют безусловные, иначе – признаки, образующие триаду Гетчинсона: 1) гетчинсоновские зубы (резцы на верхней челюсти имеют бочкообразную форму и выемку на переднем крае; 2) паренхиматозный кератит; 3) лабиринтная глухота. Они нередко встречаются одновременно. Признаки, патогномоничные для позднего врожденного сифилиса и в то же время встречающиеся и при других нозологических формах, отнесены в группу вероятных. Ими являются деформация мало берцовых костей по типу «саблевидных голеней», нарушение развития костно—мышечных элементов черепа по типу «готического неба», утолщенный медиальный конец ключицы, всевозможные нарушения развития и формирования зубов такие, как диастема, макро– или микродентия, недоразвитие клыков и др. При постановке диагноза необходимо основываться как на особенностях клинических симптомов и лабораторных данных, так и на результатах диагностики вероятного источника заражения. Реакция Вассермана (РВ) положительная у всех больных во второй половине первичного периода и в течение всего вторичного. В третичном периоде заболевания реакция может быть отрицательной у 30 % больных. Поэтому предпочтительнее по возможности использование новых и более совершенных методов сывороточной диагностики. К ним относятся реакция иммунофлюоресценции (РИФ) – при наличии у обследуемого пациента сифилиса она дает положительный результат в почти в 100 % случаев вне зависимости от периода заболевания. Реакция иммобилизации бледных трепонем (РИБТ) при наличии сифилиса у больного дает с высокой степенью достоверности положительный результат во вторичном и третичном периодах. Если при отсутствии каких—либо клинических проявлений у больного сохраняются положительные результаты серологических тестов несколько раз подряд, то следует думать о наличии у пациента латентного сифилиса. В терапии сифилиса используются антибактериальные препараты группы пенициллинов. Раньше практиковалось назначение постоянного приема препаратов, но в настоящее время чаще прибегают к курсовой терапии. Ее продолжительность, компоненты и их дозировка, а также пути введения выбираются лечащим врачом в соответствии с сопутствующей патологией у больного, стадии выраженности проявлений заболевания. Применяют также неспецифическую терапию (пирогенные вещества, витамины, биологически активные добавки, иммуномодуляторы), особенно при вторичном рецидивном и латентном сифилисе. Лечение начинают в стационаре. После завершения лечения все больные без исключения должны находиться под продолжительным наблюдением длительностью от 1 года до 5 лет. По истечении этого периода их тщательно исследуют и, если признаков заболевания или положительных результатов серологических не выявлено, снимают с учета. Основой профилактики сифилиса является повышение общекультурного уровня общества посредством проведения научно—просветительской работы, пропаганды здорового образа жизни и важной роли личной и социальной гигиены, проведения регулярных медицинских обследований. Важным компонентом борьбы с распространением инфекции является активное выявление и госпитализация всех больных, четкий контроль за ними до снятия с учета, поиск и выявление источников заражения, обязательное обследование беременных и проведение им и всем больным, находящимся на стационарном лечении, реакции Вассермана, санитарно—просветительная работа, организация пунктов индивидуальной профилактики при вендиспансерах. ЛЕЧЕНИЕ И ПРОФИЛАКТИКА СИФИЛИСА У ДЕТЕЙ Для лечения детей также с успехом используют препараты пенициллина. Детям младше двух лет предпочтительнее назначать внутримышечно натриевую и новокаиновую соли бензилпенициллина в дозе 100 000 ЕД на килограмм для детей младше шести месяцев, далее с увеличением возраста на каждые шесть месяцев, доза пенициллина на килограмм массы тела уменьшается на 25 000 ЕД. Обычный пенициллин вводят шесть раз в сутки, дозу новокаиновой соли пенициллина разделяют на два приема. Детям старше двух лет можно назначать бициллины–1, 3, 5, которые назначают по 300 000 ЕД в сутки однократно. Если при этом препарат переносится хорошо, то вскоре рекомендуют переходить на внутримышечное введение 600 000 ЕД (причем по половине дозы вводят в обе ягодицы) через день. В случае если ребенок не переносит пенициллины, можно использовать ампициллин или оксациллин. Превентивное лечение проводят в течение двух недель, продолжительность профилактического лечения составляет как правило 2–4 недели. В случае раннего врожденного сифилиса назначается специфическое лечение длительностью около одного месяца, если у ребенка выявлен поздний врожденный сифилис, то в течение месяца ему будет назначаться терапия антибактериальными препаратами в комбинации с висмутовыми препаратами. В течение двух недель лечат детей со свежими формами приобретенного сифилиса. Рецидивы и латентные формы следует лечить как минимум месяц. Оксациллин назначают внутримышечно в следующих суточных дозах: новорожденным – 240 мг/кг массы тела, детям в возрасте до 3 месяцев – 200 мг/кг, от 3 месяцев до 2 лет – 1,0 в сутки, от 2 лет и старше – 2,0 г в сутки. Возможно применение оксациллина внутрь, за 1 ч до еды или через 2–3 после нее в следующих суточных дозах: новорожденным 90—150 мг/кг, в возрасте до 3 месяцев 200 мг/кг, от 3 месяцев до 2 лет и старше 2,0 г в сутки. Ампициллина натриевую соль применяют внутримышечно в следующих дозах: новорожденным – 100 мг/кг, остальным детям – 50 мг/кг, максимально – 2,0 г в сутки. Суточную дозу делят на 4–6 инъекций. Суточную дозу таблетированных форм ампициллин разделяют на несколько приемов, которые не обязательно должны быть связаны с приемом пищи. В случае непереносимости полусинтетических пенициллинов возможно использование эритромицина детям в возрасте от 1 года до 3 лет – в дозе 0,4 г в сутки, 3–6 лет – 0,5–0,75, 6–8 лет – 0,75, 8—12 лет до 1,0 г всутки. Препарат дают равными дозами 4–6 раз в сутки. Обязательным компонентом терапии должны быть противоаллергические препараты (кестин, супрастин, тавегил, лоратадин, цетрин, ксизал и другие) во избежание развития аллергических реакций на антибактериальные препараты. Желателен также прием препаратов кальция. Превентивное лечение. Если установлена возможность заражения детей от пораженных сифилисом людей при бытовом контакте, либо по прошествии не более трех месяцев после последнего контакта зараженным сифилисом, проводится превентивное лечение. Если срок, прошедший с момента контакта, превышает три месяца, то ребенку необходимо пройти детальное обследование на выявление сифилиса. В том случае, если признаки заболевания у ребенка отсутствуют, то ему назначается повторное обследование через полгода после последнего контакта с больным, и лечение не проводится. Если ребенку перелита кровь, содержащая бледную трепонему, то в течение трех месяцев с момента трансфузии ему проводят лечение по всем стандартам, соответствующим лечению первичного периода серопозитивной формы сифилиса, и подлежат диспансерному наблюдению в течение последующих двух лет. Профилактическое лечение. Если мать ребенка болеет, или перенесла сифилис ранее, либо контактировала с зараженными сифилисом будучи беременной, то ребенок в первые три месяца жизни должен находиться под пристальным медицинским контролем, ему должны быть проведены все доступные методы исследования и консультации специалистов на предмет выявления сифилиса его осложнений. По показаниям необходимо выполнение люмбальной пункции. Как вариант профилактического лечения можно использовать пенициллин или в случае противопоказаний оксациллинн, ампициллин, препараты группы макролидов, цефалоспоринов III поколения. Если же мать получала адекватное лечение до беременности и в течение ее с профилактической целью, то ее ребенку профилактическое лечение не проводят. Как и в случае, если мать до беременности получила полноценное специфическое лечение, а у родившегося ребенка отсутствуют клинические, рентгенологические и серологические проявления заболевания. Если же мать не получала адекватного лечения во время беременности и до нее, то ребенку необходимо провести лечение согласно курсу, положенному при раннем врожденном сифилисе. Длительность профилактического лечения детей, матери которых не получали такового, составляет 15 дней, каждый день ребенку назначается по 100 000 ЕД антибактериального препарата пеницилинового ряда на 1 кг массы тела ребенка, прием лекарства шестикратный, строго через каждые 4 ч. Детям, матери которых получили профилактическое лечение не в полном объеме, с положительными результатами сывороточных реакций, назначают профилактическое лечение на 21–й день в той же терапевтической дозе. Если клинические и лабораторные признаки, говорящие за наличие сифилиса у ребенка сомнительны, то проводится курс антибиотикотерапии в течение двух недель с последующим проведением детального медицинского контроля. Специфическое лечение детей, больных врожденным сифилисом, проводится стационарно в течение четырех недель с использованием бензилпенициллина в форме его натриевой или новокаиновой солей. Детям с поздним врожденным сифилисом назначают также пенициллин в комбинации с препаратами висмута. Лечение начинают бийохинилом или бисмоверолом, которые вводятся внутримышечно два раза в неделю в возрастной дозировке: для детей до 3 лет – бийохинолы в разовой дозе 0,5 мл, 12,0—15,0 мл на курс; бисмоверол в разовой дозе 0,2–0,4 мл, по 4,0–4,8 мл на курс. Для детей 3–5 лет – бийохинол 1–1,5 мл, по 15,5—20 мл на курс и бисмоверола в разовой дозе 0,4–0,6 мл по 8 мл на курс. Для детей от 6 до 10 лет бийохинолы назначаются в разовой дозе 1–2 мл по 20–25 мл на курс лечения, бисмоверол в разовой дозе 0,4–0,8 мл до 10 мл на весь курс лечения. Для детей в возрасте 11–15 лет бийохинолы назначают в дозах 1–2 мл на один прием с курсовой дозой 30 мл, бисмоверол 0,6–0,8 мл с курсовой дозой 10–12 мл. ГЛАВА 3. ТУБЕРКУЛЕЗ Туберкулез – инфекционное заболевание, вызывается специфическим возбудителем – микобактериями туберкулеза. ПРИЧИНЫ И МЕХАНИЗМЫ РАЗВИТИЯ Различается несколько видов микобактерий – человеческий, бычий, птичий, которые патогенны для человека и при заражении ими могут вызвать туберкулез. Имеется также большая группа микобактерий, которые принято называть атипичными, они условно патогенны для человека. При заражении ими и развитии заболевания его называют микобактериозом. Основным источником заражения микобактериями туберкулеза является больной человек, выделяющий в окружающую среду возбудителя болезни при кашле, чихании, разговоре, плевках и др. Определенную опасность для человека представляет больной туберкулезом крупный рогатый скот, в меньшей мере – другие животные, в том числе домашние; заражение в этих случаях наступает микобактериями бычьего вида. Куры изредка также могут быть источником заражения человека птичьим видом микобактерий; болезнь характеризуется тяжелым прогрессирующим течением. Заражение происходит чаще всего аэрогенным путем, возбудитель проникает через бронхиальное дерево в легкие. Возможно также заражение алиментарным путем – через желудочно—кишечный тракт и редко – контактным путем. Постепенно развивается аллергия; от момента заражения до ее появления проходят 4–6 недель, иногда больше. Совокупность развивающихся изменений аллергического характера принято называть термином «повышение чувствительности замедленного типа». Это состояние характеризуется, в частности, наличием антител. Первичное заражение может наступить в детстве, чаще – в подростковом возрасте. При неосложненном первичном туберкулезе при лечении наступает заживление с минимальными остаточными изменениями, при осложненном и прогрессирующем течении также может наступить заживление, но с уже более выраженными остаточными изменениями. КЛАССИФИКАЦИЯ Классификация туберкулеза сложна и неоднородна, учитывает наряду с легочными и внелегочные проявления инфекции. Следующие признаки были взяты в основу клинической классификации туберкулеза: клинико—рентгенологические особенности клинических форм туберкулеза, его течение, т. е. фазы, бактериовыделения, протяженность (локализация) процесса. Клиническая классификация туберкулеза А. Основные клинические формы. Группа 1 – туберкулезная интоксикация у детей и подростков. Группа 2 – туберкулез органов дыхания. 1. Первичный туберкулезный комплекс. 2. Туберкулез внутригрудных лимфатических узлов. 3. Диссеминированный туберкулез легких. 4. Очаговый туберкулез легких. 5. Инфильтративный туберкулез легких. 6. Туберкулема легких. 7. Кавернозный туберкулез легких. 8. Фиброзно—кавернозный туберкулез легких. 9. Цирротический туберкулез легких. 10. Туберкулезный плеврит (в том числе эмпиема). 11. Туберкулез верхних дыхательных путей, трахеи, бронхов и др. 12. Туберкулез органов дыхания, комбинированный с пылевыми профессиональными заболеваниями легких. Группа 3 – туберкулез других органов и систем. 1. Туберкулез мозговых оболочек и центральной нервной системы. 2. Туберкулез кишечника, брюшины и брыжеечных лимфатических узлов. 3. Туберкулез костей и суставов. 4. Туберкулез мочевых, половых органов. 5. Туберкулез кожи и подкожной клетчатки. 6. Туберкулез периферических лимфатических узлов. 7. Туберкулез глаз. 8. Туберкулез прочих органов. Б. Характеристика туберкулезного процесса. Локализация и протяженность: в легких по долям и сегментам, а в других системах – по локализации поражения. Фаза течения туберкулезного процесса: а) инфильтрация, распад, обсеменение; б) рассасывание, уплотнение, рубцевание, обызвествление. По наличию возбудителя в мокроте (бацилловыделению): а) больные с выделением микобактерий туберкулеза (БК+); б) больные без выделения микобактерий туберкулеза (БК-). В. Осложнения. Легочное кровотечение, спонтанный пневмоторакс, легочно—сердечная недостаточность, ателектаз, амилоидоз, почечная недостаточность, свищи бронхиальные, торакальные и др. Г. Остаточные изменения после извлеченного туберкулеза. а) по системе органов дыхания: фиброзные, фиброзноочаговые, буллезные изменения, наличие кальцинатов в легких и лимфатических узлах, плевропневмосклероз, цирроз, бронхоэктатические явления, состояния после хирургического вмешательства и др.; б) по другим системам: рубцовые изменения в различных органах и их последствия, обызвествления, состояние после оперативных вмешательств. ТУБЕРКУЛЕЗ ОРГАНОВ ДЫХАНИЯ, МЕТОДЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ Туберкулез органов дыхания включает поражения легких, внутригрудных лимфатических путей, плевры и перикарда, крупных и мелких бронхов, трахеи, гортани. При изучении анамнеза особое внимание следует уделить выявлению контакта с больными туберкулезом, а также указаниям на заболевание туберкулезом членов семьи и ближайших родственников. Специфических симптомов, типичных только для туберкулеза, нет. Тем не менее необходимо обратить внимание на синдром интоксикации (повышение температуры тела, слабость, снижение аппетита) и «грудные симптомы»: кашель, выделение мокроты, кровохарканье, боли в груди, одышка. Также на притупление перкуторного звука, измененное дыхание, хрипы в легких. Наиболее важным методом является рентгенологическое исследование: рентгенография и томография органов грудной клетки в прямом и боковом положении больного. Поражение трахеи и крупных бронхов выявляется при бронхоскопии. Бронхологический метод позволяет получить материал из легких и внутригрудных лимфатических узлов для последующего цитологического исследования. Из лабораторных методов наиболее важным и информативным является микроскопическое и бактериологическое исследование материала на наличие микобактерий туберкулеза. Туберкулиновые пробы: внутрикожный тест Манту или градуированная накожная проба с различными концентрациями туберкулина имеет очень большое значение в детской практике и при дифференциальной диагностике туберкулеза с другими заболеваниями в любом возрасте. Противотуберкулезные препараты Палочка Коха (микобактерия туберкулеза) чувствительна к большому числу антибактериальных препаратов. Все они имеют разное химическое строение, фармакокинетику и фармакодинамику. Для клинических специалистов наиболее приемлемой является градация данных препаратов по выраженности терапевтического эффекта, в соответствии с которой выделяют противотуберкулезные препараты первой линии (в России к ним относят изониазид, этамбутол, рифампицин, стрептомицин, пиразинамид, а в других странах еще и амикацин, капреомицин, рифабутин и препараты группы налидиксовой кислоты II и III поколений) и препараты второй линии (фторхинолоны, протионамид, рифабутин, циклосерин, канамицин, этионамид, амикацин, капреомицин). По рекомендациям международного общества борьбы с туберкулезом в зависимости от степени эффективности противотуберкулезные препараты разделяют на III группы. I группа антибактериальных средств с высокой степенью эффективности: изониазид, рифампицин. II – антибиотики средней степени эффективности: стрептомицин, протионамид, канамицин, циклосерин, этамбутол, этионамид, флоримицин (виомицин), пиразинамид. III – препараты с наименьшей эффективностью при клиническом применении: парааминосалициловая кислота, тиоацетазон. Как видно из представленных данных, наиболее выраженным бактерицидным эффектом и, следовательно, наибольшей эффективностью при лечении среди всех противотуберкулезных препаратов обладают изониазид и рифампицин, отнесенные к первой линии. В свете этого на сегодняшний день тактика лечения больных основывается на применении в первую очередь противотуберкулезных препаратов в сочетании с антибиотиками I и II групп. Такой подход в абсолютном большинстве случаев высокоэффективен и приводит к излечению 90–95 % больных. За рубежом существуют сложные препараты, имеющие в своем составе II–III антибиотика с обязательным наличием рифампицина или изониазида, заменяющие сложные многокомпонентные схемы. Опыт их использования в России пока недостаточен. Противотуберкулезные средства второй линии являются препаратами резерва и используются при непереносимости пациентами антибиотиков первой группы, при их неэффективности, а также для лечения особых, так называемых полирезистентных, форм туберкулеза. Режим их применения основывается на клиническом варианте туберкулеза у данного пациента, чувствительности выделенного штамма, предшествующей медикаментозной терапии, длительности течения заболевания. Выбор режима терапии Основным ориентировочным фактором в выборе режима противотуберкулезной терапии имеют особенности выделенного штамма микобактерии туберкулеза и длительность ее персистирования в организме. На основе этих критериев всех больных разделяют на следующие группы. 1. Больные, у которых туберкулез обнаружен в первый раз, впервые зарегистрированные случаи вновь развившегося туберкулеза легких, при которых анализ мазков на кислотоустойчивые бактерии оказался положительным, больные с тяжелыми формами легочных и внелегочных вариантов туберкулеза. 2. Ко второй группе следует причислять пациентов с рецидивирующим течением заболевания, пациентов, не ответивших на проводимую терапию адекватной положительной динамикой, больных, курс терапии которых не был завершен. Если после проведения курса противотуберкулезной терапии отмечается положительная динамика, а анализ мазка мокроты на кислотоустойчивые микобактерии отрицателен, то проводят лечение по второй ступени терапии, в остальных случаях первоначальный курс лечения назначается еще на месяц. 3. Больные с вялотекущими внелегочными формами туберкулеза и отграниченными участками поражения в легких, имеющие отрицательный анализ мокроты на палочку Коха. В основном эту категорию составляют дети и подростки. 4. К четвертой категории относят пациентов, длительно страдающих хроническими формами туберкулеза, с высокой степенью устойчивости к антибактериальным препаратам первой линии. В этих случая используются препараты группы резерва в различных сочетаниях, длительность применения определяется индивидуально для каждого пациента. Ведение таких пациентов представляет значительные трудности как для врача, так и для самого больного, так как высок риск развития осложнений, а характер прогрессирования инфекции зачастую сложно предугадать. Схемы терапии Весь курс противотуберкулезной терапии состоит из двух фаз: начальной – с применением высокоэффективных препаратов первой линии для эрадикации микобактерий туберкулеза, и поддерживающей – предотвращения рецидивов, реинфекции. Назначенная схема лечения отражается шифром с указанием продолжительности курса данной фазы в месяцах, первых букв названия препарата, кратности приема препарата в сутки или в неделю, если он назначается менее чем раз в сутки. После проведения первой фазы лечений проводят анализ на кислотоустойчивые бактерии и в случае его отрицательного результата переходят к лечению согласно второй фазе химиотерапии. После ее завершения анализ мазка на кислотоустойчивые бактерии проводится повторно. Если же после проведенного лечения первой фазы анализ мокроты положителен, то первую фазу лечения продлевают еще на месяц. Для удобства ориентирования и оценки исследований, адекватного и унифицированного подхода к пациентам практикующих врачей ВОЗ предложены единые критерии для оценки результатов анализов на кислотоустойчивые бактерии и разработки дальнейшей тактики ведения больных. Согласно этим критериям: 1) анализ мокроты на кислотоустойчивые бактерии считается положительным, если: при ее микроскопическом исследовании палочки Коха определяются как минимум двукратно; либо если кислотоустойчивые бактерии выявляются в мокроте однократно, а на рентгенограммах органов грудной клетки имеются признаки, характерные для активно протекающего процесса легочного туберкулеза; или в том случае, если при микроскопии мокроты как минимум одна проба оказывается положительной, и микобактерия туберкулеза высевается при микробиологическим исследовании; 2) анализ мокроты больного отрицателен, если при микроскопии мазков мокроты не менее двух раз регистрируется отрицательный результат, а при рентгенографии органов грудной клетки выявляются признаки, свойственные активной форме туберкулеза; либо если микроскопически как минимум однократно в мокроте не выявлены микобактерии, но при посеве высевается палочка Коха. 3) внелегочный туберкулез регистрируется тогда, когда имеется гистологическое заключение, подтверждающее наличие микобактерии туберкулеза и активного специфического воспалительного процесса, либо выраженные клинические признаки, говорящие в его пользу, либо комбинация первого и второго условий; или те случаи, когда хотя бы один посев материала, взятого из внелегочного очага поражения, позволяет выделить культуру микобактерии туберкулеза; 4) как новый случай расценивается вариант, когда пациент никогда не лечился противотуберкулезными лекарственными средствами более 1 месяца; 5) рецидив – случай заболевания, развившийся после того, как ранее фтизиатром было констатировано полное излечение; 6) неудача при лечении – вновь выявленный случай заболевания, при котором больной остается резистентным к проводимой терапии, а анализы мазков мокроты на кислотоустойчивые бактерии сохраняются положительными на протяжении пяти месяцев и более после проведения терапии противотуберкулезными препаратами первой линии; либо пациент, который с положительными реакциями мазков на кислотоустойчивые бактерии после назначения терапии не получал препараты более двух месяцев, но менее пяти; 7) излечение констатируется в тех случаях, если мазки мокроты минимум дважды оказываются отрицательными после проведенного двухфазного лечения; 8) возобновленное лечение после перерыва – больной снова получает противотуберкулезные препараты по прежней схеме после перерыва в проведении химиотерапии продолжительностью более двух месяцев; 9) курс лечения считается выполненным тогда, когда больной получил более 80 % прописанных ему противотуберкулезных лекарственных средств; 10) перерывом называют промежуток более двух месяцев, в течение которого больной по каким—либо причинам не получает назначенной ему терапии; 11) хронический случай – больной, анализы мазков мокроты которого остаются положительными после по окончании повторного курса лечения, проводимого под контролем медицинского персонала. Стандартный девятимесячный режим терапии Пациент принимает по 0,3 г изониазада и по 0,3 г рифампицина в день в таблетированной форме утром натощак. Длительность такой схемы лечения составляет примерно девять месяцев. Эффективность такого курса высока в отношении легочных форм и при внелегочных локализациях специфического воспалительного процесса. Если к одному или обоим указанным препаратам имеется резистентность, то к этой схеме следует добавлять пиразинамид в дозе 0,025 г на килограмм массы тела, 1 г стрептомицина или этамбутол в дозе 0,025 г на килограмм массы тела. Эта схема лечения на сегодняшний день пользуется меньшей популярностью у врачей в силу наличия более коротких по продолжительности курсов терапии. Шестимесячный режим терапии В настоящее время более эффективной считается так называемая квадротерапия в течение полугода: назначение четырех мощных антибактериальных препаратов одновременно – рифампицин, стрептомицин, изониазид, пиразинамид. Применение этих препаратов составляет первый этап лечения (интенсивную фазу), который продолжается в течение двух месяцев. Основными здесь являются рифампицин и изониазид, стрептомицин при его отсутствии может быть заменен на этамбутол. При эффекте от проведенного лечения переходят ко второй фазе, ее основу составляет прием рифампицина и изониазида в течение следующих четырех месяцев. Общая продолжительность курса лечения может быть увеличена, если у данного штамма возбудителя имеется устойчивость к рифампицину: в этом случае длительность лечения составит 1,5–2 года. При этом наличие устойчивости возбудителя к изониазиду не влияет на клинический эффект квадротерапии в значительной степени и не является поводом к увеличению продолжительности курса лечения. Лечение проводится под непосредственным контролем медицинского персонала. По результатам некоторых исследований, было замечено, что причиной неудач в лечении туберкулеза в большинстве случаев является не резистентность возбудителя к каким—либо препаратам, а в большей степени нарушение режима назначенной терапии: нерегулярность приема лекарственных средств, несоответствие принимаемых доз препаратов. Причинами несоблюдения больными схем лечения могут быть как отсутствие заинтересованности и веры у больного и его близких в успех лечения, так и забывчивость больных в тех случаях, когда им предписаны новые курсы лечения, предусматривающие прием препаратов реже чем один раз в сутки. Лечение под контролем медицинского персонала предусматривает контроль за своевременным приемом больным всех назначенных ему препаратов, такой подход значительно повышает эффективность проводимой терапии и уменьшает вероятность развития резистентности к компонентам терапии. Курсы химиотерапии туберкулеза с продолжительностью менее 6 месяцев Несмотря на полученные данные об эффективности новых схем лечения продолжительностью менее полугода (двух– и четырехмесячные курсы) применительно к некоторым легким формам туберкулеза, лидирующим постулатом в лечении туберкулеза остается проведение химиотерапии в течение как минимум шести месяцев. Терапия множественнорезистентного туберкулеза Безусловно, желательным мероприятием, которое следует провести до назначения больному лечения, является определение чувствительности возбудителя к антибактериальным препаратам у каждого отдельно взятого больного. В случае наличия устойчивости микроорганизма к какому—либо противотуберкулезному препарату первой линии следует заменять их резервными средствами, к которым относятся фторхинолоны, представленные офлоксацином, спарфлоксацином, ципрофлоксацином и др., аминогликозиды (амикацин, канамицин), циклосерин, капреомицин, этионамид. В случае развития рецидива назначается повторный курс лечения. Однако чтобы правильно избрать наиболее подходящую тактику терапии, необходимо проанализировать возможные причины рецидивирования инфекции. Так, скорое проявление рецедива после получения отрицательных результатов на микроскопии мокроты несколько раз подряд, как правило, указывает на преждевременную отмену препаратов. В этом случае необходимо возобновить прием лекарственных средств в прежних дозах, так как чувствительность микроорганизмов к препаратам еще остается, и при своевременном возвращении к проводимой терапии отмечается положительный эффект. Если причиной рецидивирования инфекционного процесса явилось приобретение возбудителем резистентности к изониазиду, то больному назначается новый курс лечения с обязательным приемом рифампицина и еще двух противотуберкулезных препаратов, к которым еще не приобретена резистентность. Длительность нового курса лечения составляет два года. Часто причиной развития рецидива инфекции является появление у возбудителя устойчивости к назначенным препаратам из—за несвоевременного их приема и несоблюдения предписанной схемы лечения в целом. При этом нужно провести анализ на чувствительность микроорганизма к антибактериальным препаратам и на основании этих результатов назначить больному новые противотуберкулезные средства с учетом чувствительности к ним выделенного штамма. В редких случаях отмечается поливалентная устойчивость возбудителя ко всем основным противотуберкулезным препаратам, о которых сказано выше. В таких ситуациях прибегают к назначению резервные препараты: парааминосалициловая кислота, циклосерин, капреомицин, этионамид. Используют одновременно четыре лекарственных средства. Возможно дополнительное назначение изониазида в высоких дозах даже при наличии к нему резистентности. Терапия туберкулеза у ВИЧ—инфицированных Поскольку многие антиретровирусные препараты взаимодействуют с препаратами группы рифампицина, следует уделять внимание профилактике взаимоослабления лекарственных средств при назначении лечения. Не следует одновременно принимать ингибиторы протеаз и рифабутин и его аналоги. При необходимости лечения одновременно инфекции ВИЧ и туберкулеза необходимо не только разделять по времени прием отдельных препаратов, но и корректировать режимы терапии. Возможно увеличение количества средств в курсе противотуберкулезной терапии и увеличение продолжительности его до года при обязательном приеме препаратов в течение еще шести месяцев после отрицательных результатов при анализе мокроты на кислотоустойчивые бактерии. Терапия туберкулеза при беременности Беременность является абсолютным противопоказанием к назначению стрептомицина в силу его токсичности для плода (возможно развитие патологии слухового анализатора у ребенка вплоть до полной глухоты) и пиразинамида, который может приводить к уродствам ребенка. В остальном тактика лечения туберкулеза у беременных не отличается от стандартной вышеописанной терапии. Терапия туберкулеза при выраженной почечной недостаточности и уремии Основная масса противотуберкулезных препаратов не влияет на почки. Однако если у больного почечная недостаточность выражена значительно, то дозы пиразинамида и этамбутола следует несколько уменьшить, а при назначении аминогликозидов отслеживать уровень их концентрации в сыворотке крови. Необходимо также учитывать, что изониазид и рифампицин больным, находящимся на диализе, нужно принимать после проведения этой процедуры, так как они выводятся при проведении этой манипуляции. Терапия туберкулеза при патологии печени В основной массе случаев при заболеваниях печени нет необходимости изменять дозировку противотуберкулезных препаратов или продолжительности курса лечения. Однако не рекомендуется проведение химиотерапии во время стадии обострения хронических гепатитов. |
|
|||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Наверх |
||||
|
|
||||
